

文档管理解决方案
Documentum
Open Text是知名的企业内容管理公司,创新源于1991年成功部署世界上靠前网络搜索引擎技术。OpenText支持近46000个客户,以及位于114个国家数百万用户,提供12种语言服务。OpenText也拥有SAP AG 的全球转销商协议,与 SAP 应用程序配套的 OpenText 解决方案作为 OpenText ECM 系列的一部分进行销售。OpenText 最近位列2009 年SAP亚太及日本地区软件解决方案合作伙伴中的成就奖三强。
Documentum是OpenText旗下一款专注于为生命医药行业提供行业标准文档管理解决方案的一个产品,其在生命医药行业深根了30多年,受到监管机构的高度认可。全球众多知名制药企业均是Documentum的用户;前50的医药健康领域里98%的企业是Documentum的用户;全球目前有超1600家生命健康行业客户。除此以外,美国FDA的7个中心使用Documentum产品20多年,并且一直持续在Documentum产品上进行投资,扩展其产品功能。欧盟EMEA也在使用Documentum。

Documentum通过给这些知名药企提供解决方案而得出的优质实践用于服务我们国内药企,从而帮助我们实现国内医药行业标准与国际接轨,并将带动企业质量体系按照国际化标准来运行。确保行业实践得到利用并遵守GxP合规要求。
医药行业文档管理面临挑战
近几年,随着FDA对中国制药企业监管力度的加强,以及NMPA对国内制药企业的质量追溯的重视,需要企业加强对内部数据可靠性的完善,不断选择信息化管理系统来加强对自身的管理。而文件又是质量保证系统的基本要素,所以文档管理越来越受到企业的重视。
医药行业的Quality & Manufacturing组织面临更多的挑战,压力比以往任何时候都要大,需要运行高效的、在尽可能低的成本下不间断的生产,同时还要符合严格的安全、质量和监管标准。在这样竞争激烈的环境中,优先需要解决的问题是管理不断增加的文件数量,帮助医药行业在合规的要求下管理他们在药品全生命周期中的所有文件内容。而OpenText Documentum利用优质的实践为医药行业提供全面解决方案以及专业的实施验证服务无疑成为众多医药企业的福星,助力企业规避风险,保护信息资产。
OpenText Documentum文档管理解决方案
Documentum近30年来一直致力于为生命医药行业提供完整的解决方案,覆盖了研发(R&D)、临床试验(eTMF)、监管提交(Submission)、生产质量(Q&M)以及一般企业内容管理,有一支致力于为生命医药行业提供完整解决方案的专业团队。虽然每一个解决方案都是针对特定业务流程及相关挑战而设计的,但是Documentum通过统一的解决方案层,提供一致的访问、合规性和安全性模型,实现各模块间的互操作和无缝信息共享。这对于确保正确的版本控制、完整的审计跟踪和促进监管提交至关重要。由于系统各模块之间的集成度很好,可以实现快速搜索、识别和检索监管提交所需内容,如果信息驻留在eTMF或Q&M中,则可以在R&D中轻松查看。
此外,通过实施行业标准的DIA EDM和eTMF参考模型,以保持一致的文件分类;而协同编辑功能和自动化工作流程可以提高工作效率并简化审核和批准流程;直观的、基于角色的易于使用的D2界面减少了人员培训成本。
系统架构
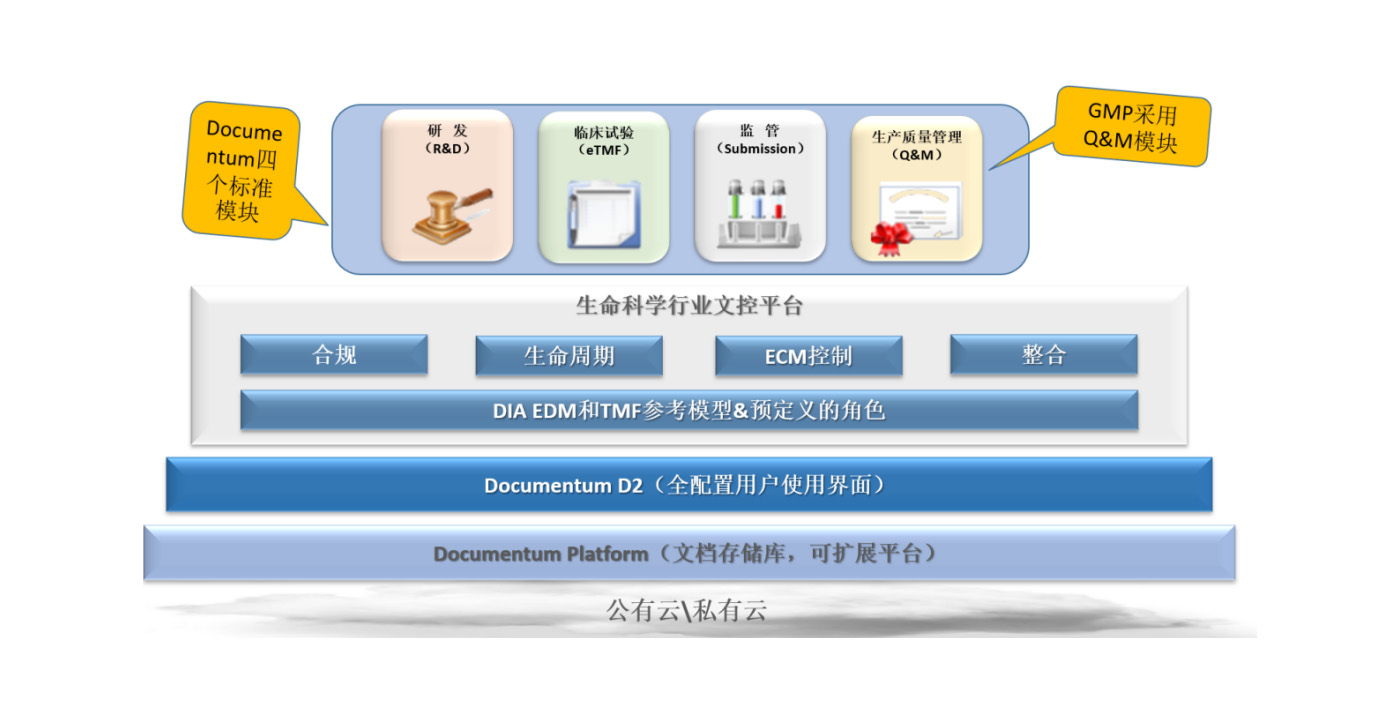
文档控制平台功能特点
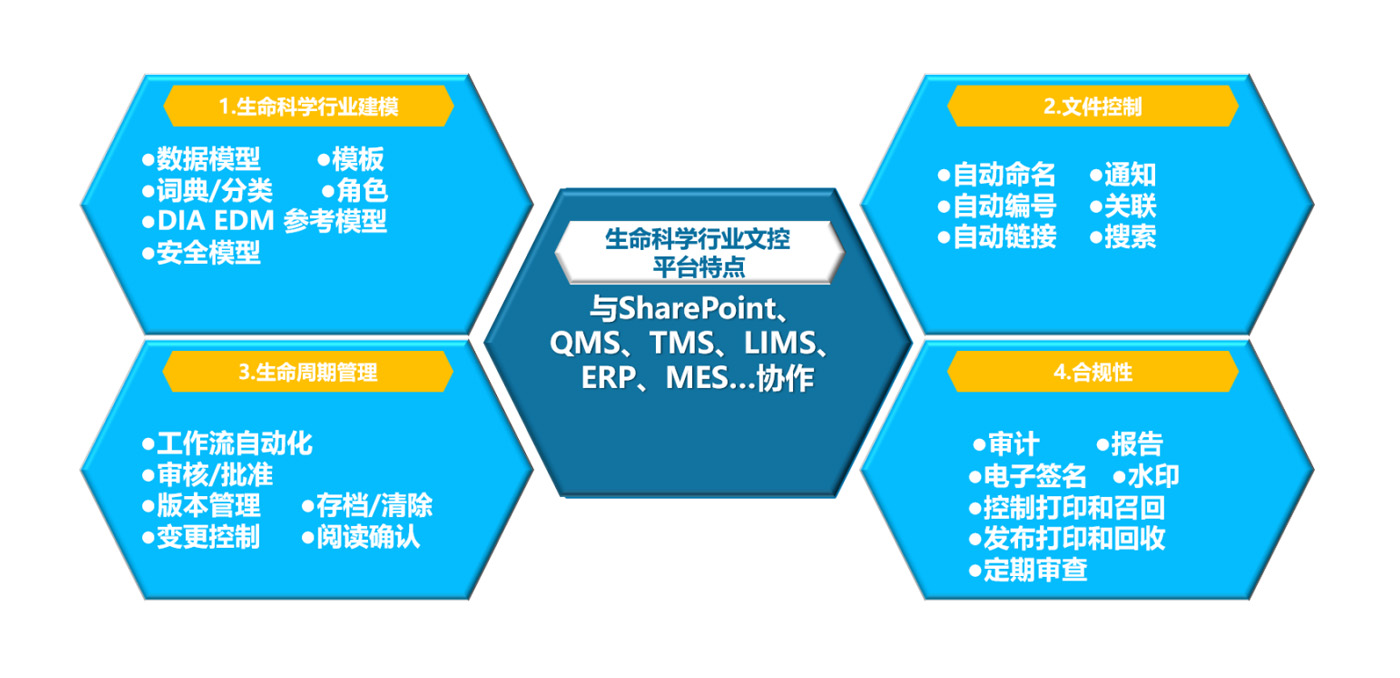
行业标准的DIA EDM参考模型

该模型旨在成为管理GMP合规性(例如SOP、策略、规范、方法等)所需文档的工件分类和文档属性(元数据)的参考。此模型是生命科学行业的参考,是作为整个行业的标准化机会,以实现更大的互操作性,并简化赞助商、业务合作伙伴和供应商/服务提供商之间的业务流程切换与GMP文件和法规遵从所需的相关内容。寻找软件供应商将这种模型作为起点分类法和元数据模型,以便客户在配置或升级其质量内容管理系统时组织其GMP合规性内容。
文档控制类别
基于DIA EDM参考模型印射到系统对文档的分类,分为四大类别:
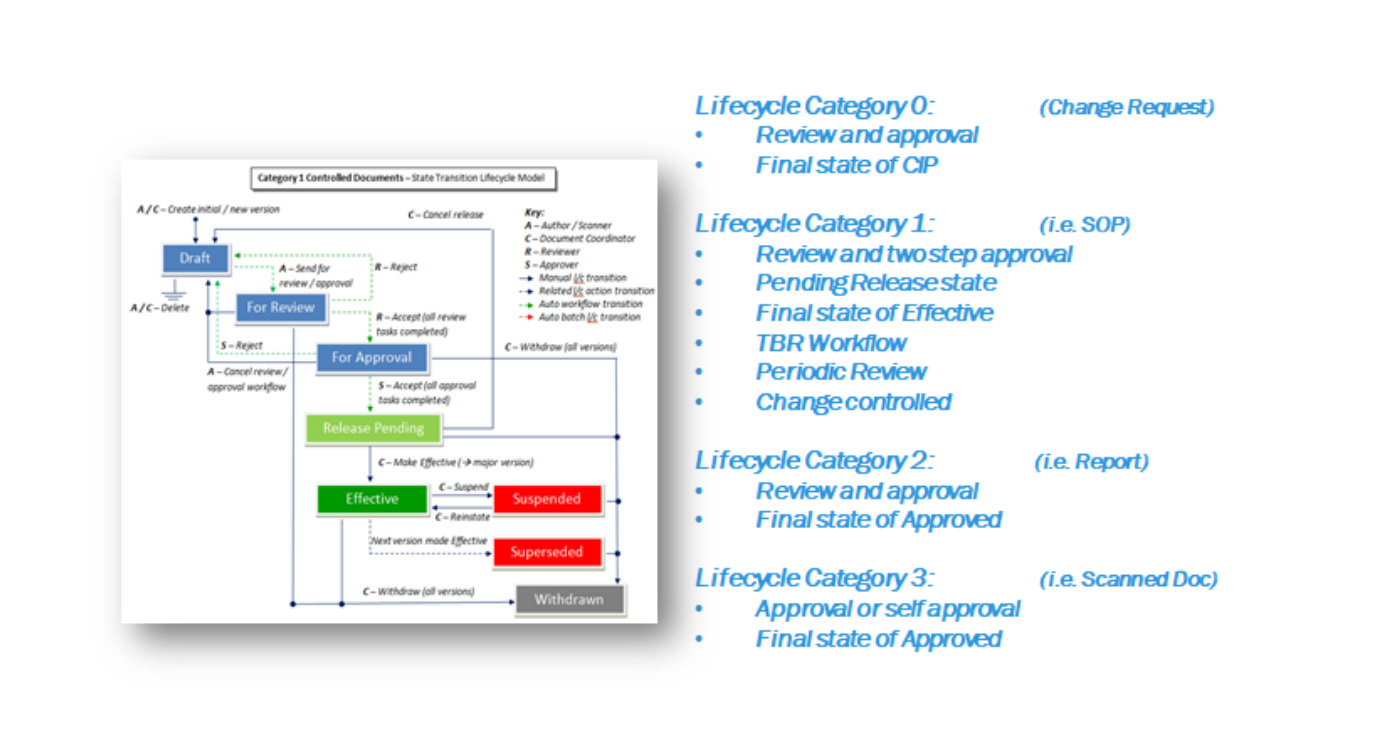
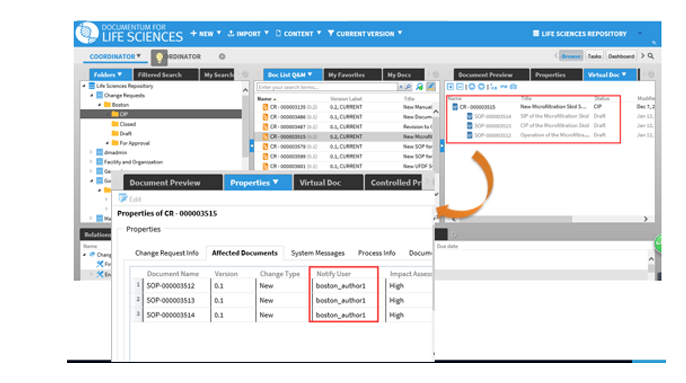
Cat 0.变更请求,与Cat1强制关联。
Cat 1.需要质量组织审批,有两级审批,最后一级为质量批准,如操作SOP、工艺规程、质量标准、批/检验记录、表单等,遵循严格的变更控制管理,跟Cat 0强制关联。
Cat 2.标准审查批准,有一级审批;如报告、验证文件、参考文件与培训相关等。
Cat 3.作者自我审批,如执行批记录、执行验证脚本扫描件等;
针对特定的文档分类系统有开箱即用的灵活的生命周期和工作流程,可以灵活的处理文档的审查和批准过程,从而可以大大提高工作效率和降低风险。
系统界面显示为一个个类似文件柜功能的文件夹结构,每个文件夹结构有多层层级结构,将所有进入系统的文件都分门别类有序的管理起来。
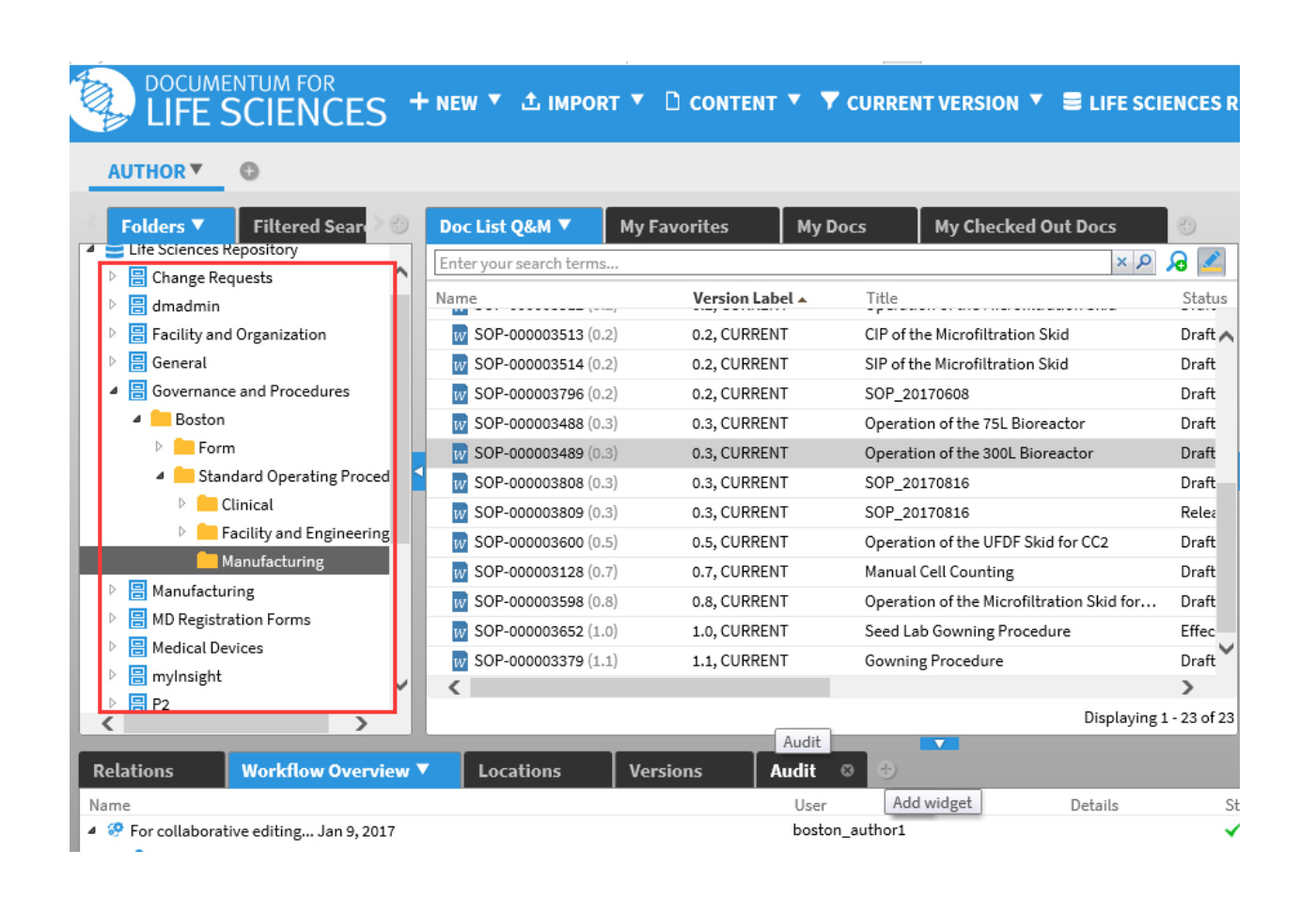
基于角色的视图和基于站点的安全控制
系统提供了可定义的角色,例如制药公司通过不同角色(如作者、审阅者、审核人、管理人员等)来管理其庞大的文档,公司内的每个人员都可依执行工作配入一个或多个角色。不同的站点创建的文档,用户看到的内容也不一样;系统基于文档生命周期而设置的角色也有不同的权限控制,系统会保证合适的人在合适的时间查看合适的内容。

搜索功能
系统包括全文搜索和高级搜索两种方式,即通过关键字段以及多重过滤手段可以快速查找所需文档;还可以通过设置标准以及逻辑条件的组合方式,即提供选择文本字段的搜索运算符的能力(‘begins with’, ‘contains’, ‘does not contain’, ‘ends with’, ‘is’, and ‘is not’)以及使用逻辑“AND”或“Or”操作在单个搜索中组合多个条件,可以快速定位所要查找的文档。
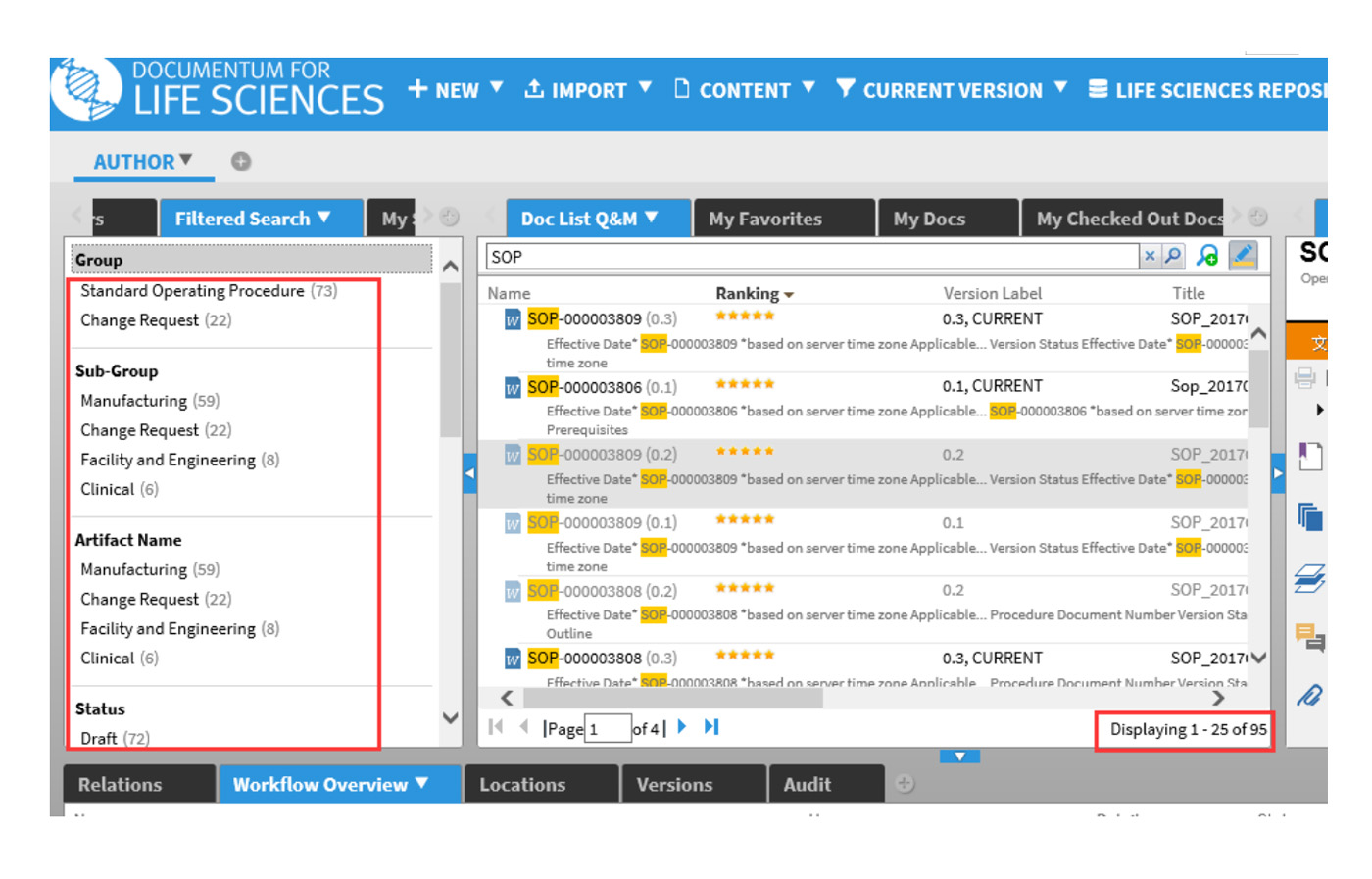
协同编辑功能
在协同编辑工作流程中,参与者可以同时打开该文档以执行其审核,并在Word文档中进行必要的修订。当迁入文档时,根据需要这些更改可供其他人使用合并。 当所有参与者完成任务时,工作流程将自动将文档发回作者进行合并。 合并在D2中自动执行。作者只需要接受/拒绝跟踪更改并完成任务即可生成一份新的文档版本。
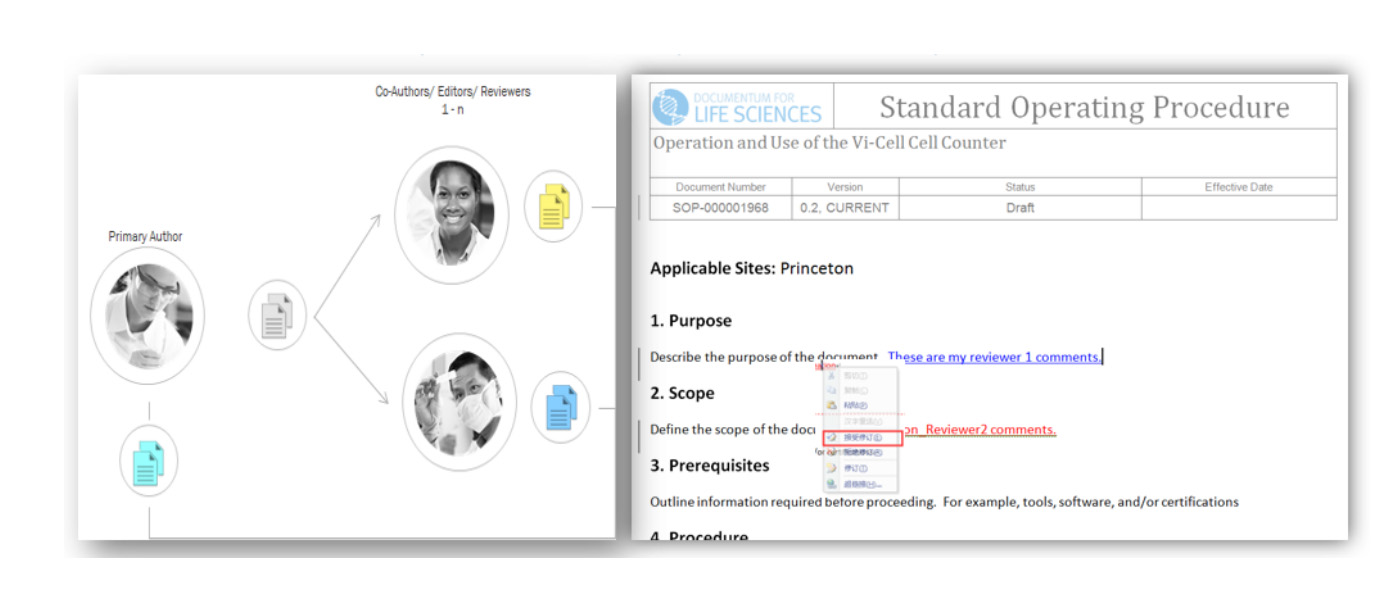 变更控制管理
变更控制管理
通常一份文档的变更会影响多份文档,系统通过创建变更请求将所有受影响的文档关联起来,当其中一份文档内容有所变更的时候,其它多份文档作者都会收到一个任务,需要对文档的变更内容进行修改确认,当所有文档达到最终批准或生效的生命周期状态时,变更请求会自动关闭。
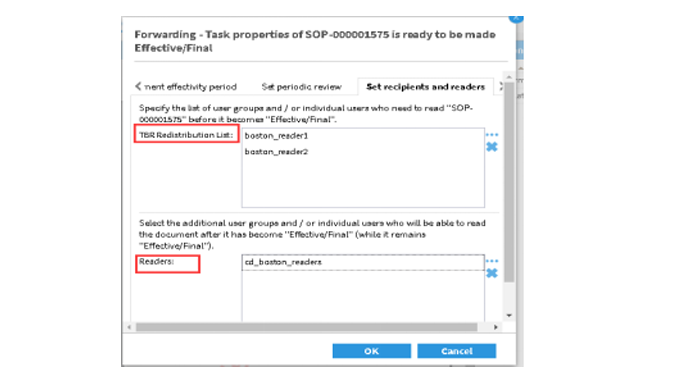
阅读确认(TBR)流程
对于控制级别严格的文档(Cat1)达到待生效状态时需要分发到相关部门来进行培训,系统提供阅读确认流程(TBR)也可以和企业培训系统进行集成,通过自动化阅读确认(TBR)过程降低了合规风险。
自动定期审核功能
Q&M中的Cat 1文件需要定期检查来复核它的合规性。当一份Cat 1文档创建的时候,在文档的属性页面可以设置定期审核时间,包括定期审核间隔、截止日期、启动时间等。文档生效之后,到达设置的时间系统会自动触发一个定期审核流程,也可以根据需要由文档控管员手动启动一个定期审核流程。审核后若需要修改将会启动文档的变更控制程序,若不需要修改将会延续下一个定期审核周期。

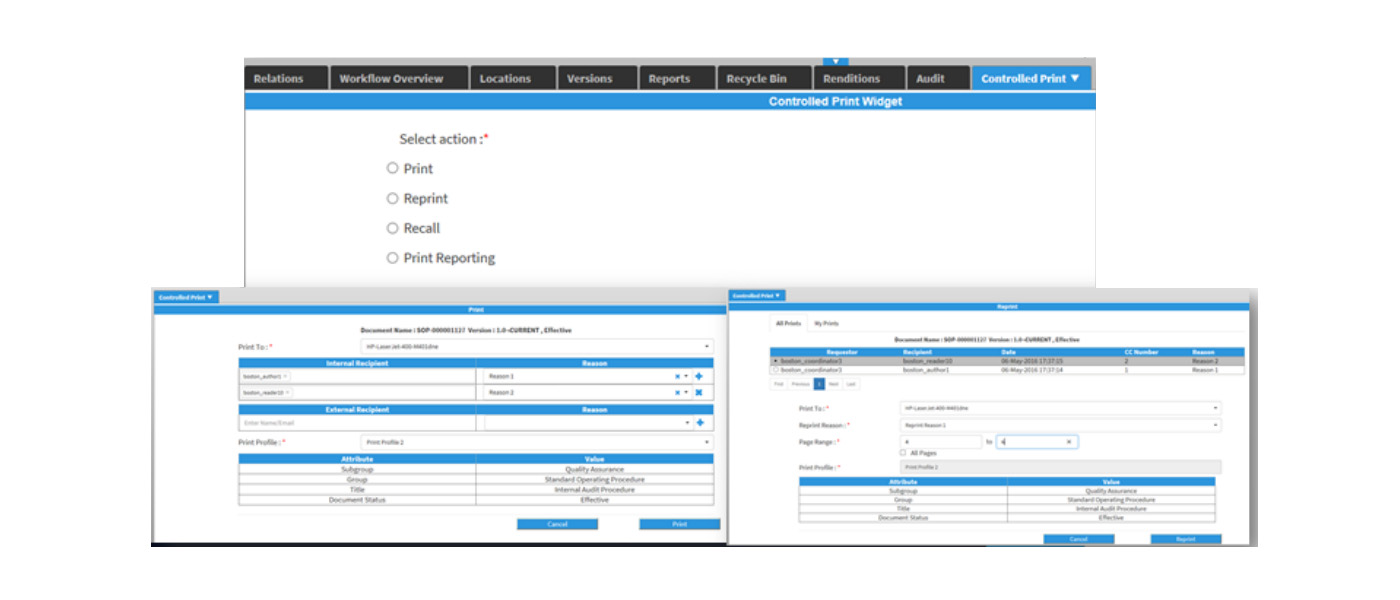
打印控制
在生产环境中发布文档的物理纸本打印是不可避免的,但是为了符合法规,质量管理部必须针对打印的纸本进行控管。系统针对不同的文档分类有不同的打印控管,打印及再印请求必须留下稽核纪录,并用以作文档召回控制。
发行打印控制(Issue Print)
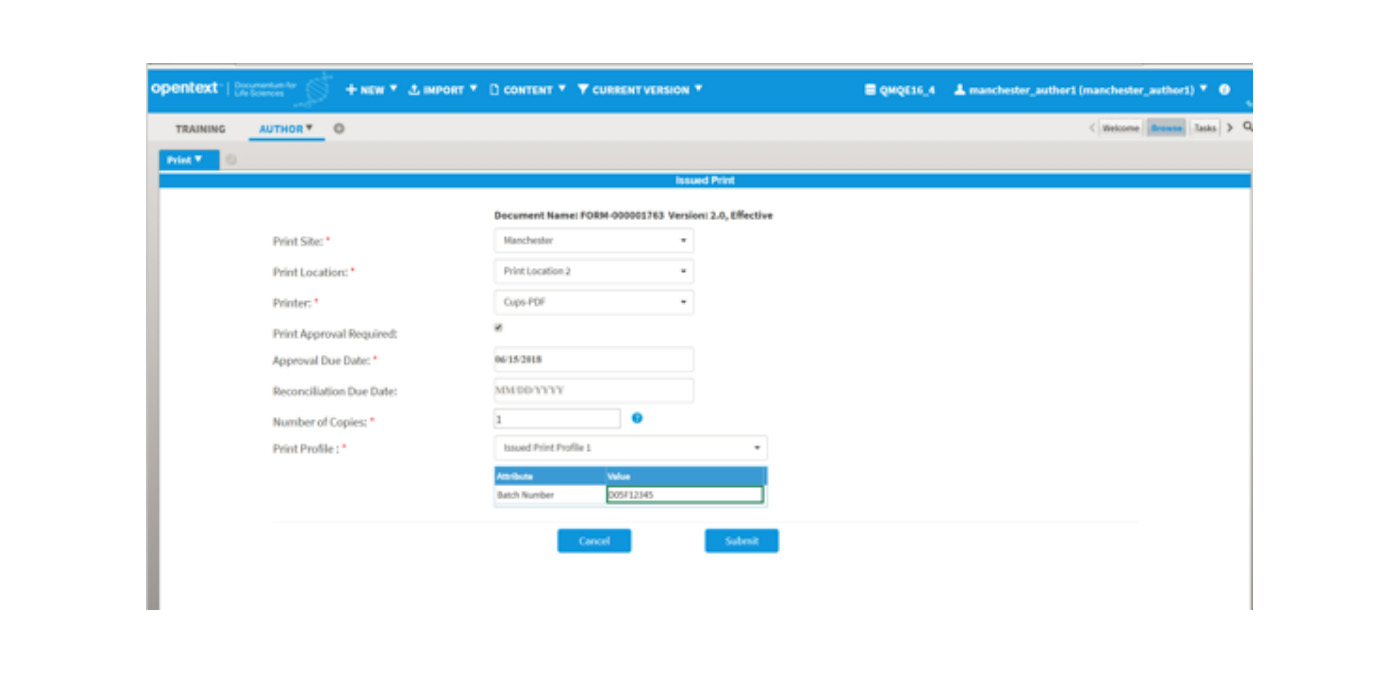
受控文档(SOP)通常会附带相关的执行表单/记录,用户利用受控文档的指示完成一个或多个相关表单/记录。这些表单/记录可以由用户在本地导出和保存以电子方式完成, 或者必须手动打印和完成。发行打印控制功能用于控制纸本表单/记录的打印,再印及召回。生产用的批记录、生产指示、持行表单等皆可利用发行打印的功能,完成全生命周期的管理。
发行打印提供打印请求审批、再印控制、召回控制,每一份打印都有单一的流水号控制,并可经由报表作审计追踪。下图是执行表单打印请求:
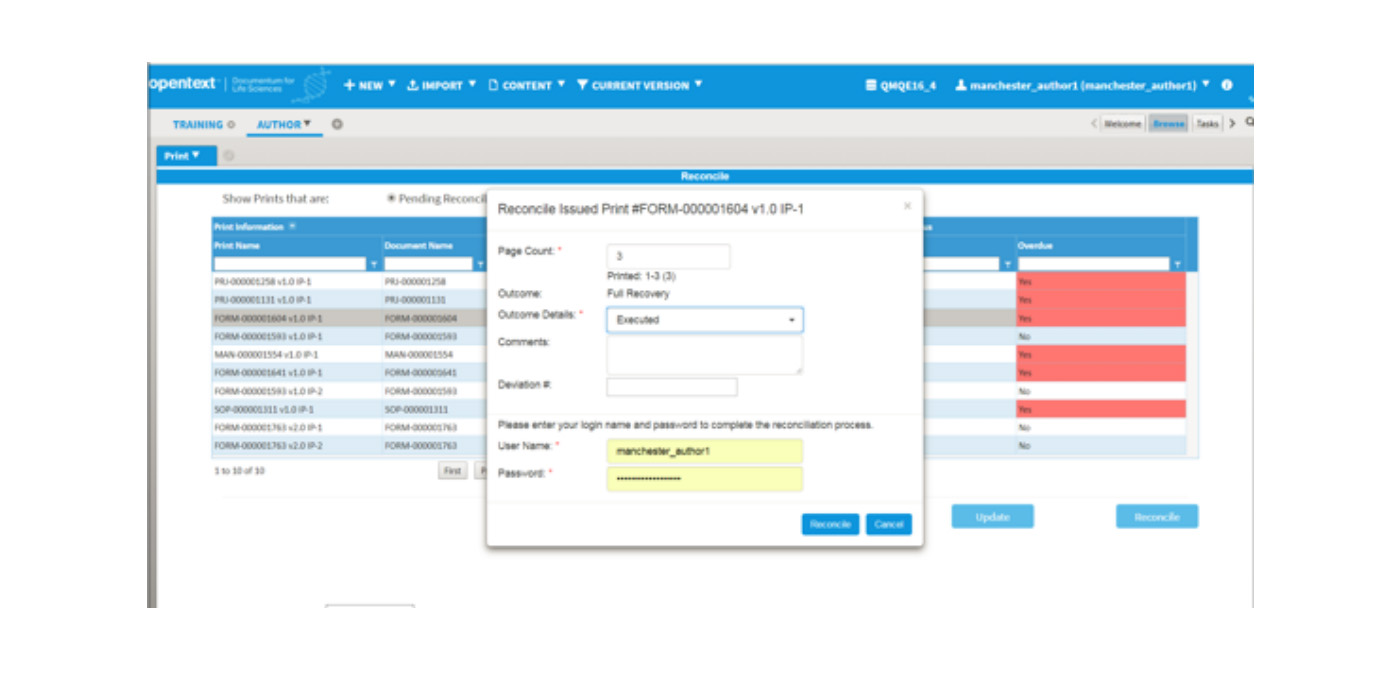
下图是执行表单的回收操作:
报告和仪表板
系统已经集成好专业的报表软件,利用系统搜索功能可以导出不同统计信息的报表台账信息,还可以利用系统标准看板功能达到快速访问系统信息的目的。例如:查看文档审计追踪、工作流、定期复审、文档培训信息等。

优势
简化合规
1.采用行业标准的DIA EDM和TMF参考模型;
2.符合 FDA 21 CFR Part 11要求(含电子签名);
3.自动化策略执行和完整的审计跟踪;
4.灵活的生命周期和工作流程,具有映射到DIA EDM和TMF参考模型工件的四级控制;
5.查看、导出和打印控制、召回用于管理受控文档;
6.纯应用配置,无需自定义编码。
完全可配置的D2界面
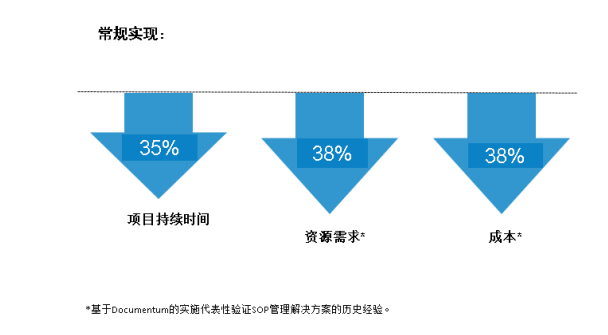
由于系统的D2界面是一个完全配置化的界面,具有非常强大的配置功能,几乎不需要任何的开发即可实现大多数客户绝大多数的需求,从而可以大大加速和简化整个项目的实施验证过程。
可扩展平台
可以和质量管理系统(QMS)、实验室信息管理系统(LIMS)、生产制造系统(MES)、培训系统(TMS)、企业资源计划系统(ERP)等进行集成,为企业未来信息化建设提供极大的便利。
完善的验证体系
对于传统本地化部署,OPENTEXT Documentum提供完善的验证文档包和服务。这个验证包包含验证计划模板、用户需求规范(URS)、用户验收测试(UAT)计划模板、UAT测试脚本、用户验收测试报告模板、跟踪矩阵(URS to UAT)、验证报告模板和生命科学Quality & Manufacturing解决方案的IQ清单。对于购买OPENTEXT Documentum标准解决方案的用户可以免费获得出厂的验证包文件。
助力企业规避风险,保护信息资产
Documentum通过将企业非结构化的内容转移到统一的ECM平台上,使得这些内容的创建、修改、跟踪、及业务过程中的利用变得高效、规范和严谨,实现六大功能:
提高研发工作效率
简化生产质量文档审核批准过程
完善药品跟踪管理
实现临床试验内容管理
缩短监管提交时间
完善企业内控、规避法规风险